Erhalten Sie Zugang zu diesem und mehr als 300000 Büchern ab EUR 5,99 monatlich.
- Herausgeber: neobooks
- Kategorie: Wissenschaft und neue Technologien
- Sprache: Deutsch
Die "Gelben Seiten" listen wichtige Firmen auf – der "Gelbe Wächter" wichtige Fachbegriffe der Chemie: Von A wie Abbaureaktion bis Z wie Zyankali – dieses Buch führt alle wichtigen Fachbegriffe der Chemie auf und bietet so eine große Hilfe für das schulische und häusliche Lernen z.B. im Distanzunterricht / Fernunterricht / Homeschooling und im Wechselunterricht / Hybridunterricht: Von A wie Abbaureaktion bis Z wie Zyankali – dieses Buch führt alle wichtigen Fachbegriffe der Chemie auf, erklärt sie in schüler(innen)gerechter Sprache und bietet so eine große Hilfe für das schulische und häusliche Lernen, ins Besondere im pandemie-bedingten Fernunterricht. Wichtige Fachbegriffe aus den Naturwissenschaften kann man nämlich ebenso lernen wie Vokabeln in den Fremdsprachen – und auf diesem "Kleinen Einmaleins" baut sich das gesamte Lehrgebäude der (Schul)-Chemie auf. Wer diese Fachbegriffe lernt und anwenden kann, der wird daher im Chemieunterricht gut klarkommen. Dieses Buch beginnt mit Erklärungen zum Grundwissen der Chemie, den "Grundbegriffen". Danach folgen die Fachbegriffe zum Nachschlagen und Lernen, zur allgemeinen, zur anorganischen und organischen Chemie, alfabetisch geordnet zum Nachschlagen. (Preiswerte ebook-Ausgabe, zum schüler/innen/freundlichen Preis)
Sie lesen das E-Book in den Legimi-Apps auf:
Seitenzahl: 325
Veröffentlichungsjahr: 2022
Das E-Book (TTS) können Sie hören im Abo „Legimi Premium” in Legimi-Apps auf:
Ähnliche
Michael Wächter
Fachbegriffe der Chemie
Definitionen, Grundwissen und Erklärungen zum Nachschlagen und Lernen in Schulen und Homeschooling
Dieses ebook wurde erstellt bei
Inhaltsverzeichnis
Titel
Vorwort
Teil 1: Basiswissen Chemie
Grundwissen: Stoffe, Stoffgemische, Stoffumwandlungen
GrundbegriffeElement und Verbindung
Grundgesetze der Chemie
Grundwissen zu Teilchen und Arten chemischer Verbindungen
Namen und Formeln chemischer Verbindungen
Grundwissen zu Atomen und Bindungen
Orbitalmodell und MO-Theorie
Alkali- und Erdalkalimetalle
Halogene und Halogenide
Säure-Base-Reaktionen (Protolyse, Protonenaustausch)
Redoxreaktionen (Elektronenaustausch)
Grundwissen zu Komplexen und ihren koordinativen Bindungen
Grundwissen zur Physikalischen Chemie
Grundwissen zuElektrizität und Elektrochemie
Grundlagen der Organischen Chemie
Merksätze Stoffgruppenorganischer Verbindungen
Merksätze Reaktionsmechanismen organischer Verbindungen
Merksätze Analytische Chemie
Teil 2: Fachbegriffe der Allgemeinen und Anorganischen Chemie
A
B
C
D
E
F
G
H
I
J
K
L
M
N
O
P
Q
R
S
T
U
V
W
X
Y
Z
Teil 3: Fachbegriffe der Organischenm Chemie
A
**Acrolein
*Acrylsäure
**acyclische Verbindungen,
**Addition,
*Adipinsäure,
**Aldehyde,
*Aldehydgruppe,
**Aldol,
**Aldosen,
**alicyclische Verbindungen,
**Aliphaten,
***aliphatische Verbindungen
*Alkane,
**Alkansulfonsäuren,
**Alkene,
***Alkine
**Alkohole,
*Alkoholyse,
**Alkylgruppe,
**Alkylhalogenide,
**Alkylierung,
**Alkylrest,
**Alkylsulfate,
***Allylgruppe,
**Amide,
**Amidosulfonsäure,
***Amine,
**Aminobenzoesäure
**Aminocarbonsäuren,
**Aminoessigsäure
***Aminogruppe,
**Aminomethan,
***Aminosäuren,
**Ammoniumbasen,
**Amylacetat
**Amylalkohol
***Amylopektin,
**Amylose,
**Anilin
**Anthracen
*Anthrachinon
**Antipoden,
**Arabinose,
***Aromaten
***Aromatisierung,
*Arylamine,
***Arylgruppe,
***Arylierung,
***asymmetrisches Kohlenstoffatom,
**asymmetrische Synthese,
*Ausschütteln,
**Austauschreaktion,
***Azobenzol,
***Azoverbindungen
***Azoxyverbindung,
**Azulen
**Baeyer
**Baeyersche Probe
**Beilstein,
***Benzaldehyd,
**Benzol,
***Benzolsulfonsäure,
***Benzonitril,
***Benzoylchlorid,
***Benzpyren,
**Bernsteinsäure,
*Bienenwachs
***Brenzcatechin
**Brenztraubensäure
**Bromaceton,
**Butadien
*Butan
**Butanol
**Buten
***Butin,
***Butylen
***Cannizzaro,
**Carbene,
**Carbolineum
**Carbonsäuren
***Carbonylgruppe
***Carboxylgruppe,
**Cetan
**Chelate
**Chinolin
**Chinone
**Chiralität
**Chloral,
**Chlorfluorkohlenwasserstoffe
**Chlorsilane,
**Chromophore
*cis-trans-Isomerie,
**CKW,
**Cyanate,
***Cyanhydrin-Synthese,
***Cyclamate,
**cyclische Verbindungen
**Cycloaddition,
***Cycloalkane,
**Cyclohexan
**Cyclohexanol,
**Cyclohexanon,
**Decarboxylierung,
**Dehalogenierung,
**Derivat
**Detektor,
**Diastereoisomerie
***Diazomethan,
***Diazotierung,
**Diazoverbindungen,
**Dicarbonsäuren
**Dichlorbenzol,
**Diehtylether
**Dioxan
**Diphenyl
**Dreifachbindung,
*E 605,
**EDTA
*einwertig,
***Eliminierungsreaktion
*Essenz
*Essigester
*Essigsäure
**Ester,
***Esterzahl,
**Ethan
***Ethanal,
**Ethanol
**Ethen
**Ether
**Ethin
**Ethylacetat
**Ethylalkohol
*Ethylchlorid
**Ethylen
**Ethylenchlorid
**Ethylenoxid
***Ethylgruppe
***Ethylmercaptan
*Fadenmoleküle,
*Fahrzeuglacke,
*Farbträger
***FCKW,
**Fischer,
**Fluorescein
***Fluorkohlenwasserstoffe
**Formaldehyd
***Formamid
**Fruchtsäuren,
**Fruchtzucker
*Fructose
***Fullerene
***Fulminate
***Fumarsäure,
*Fuselöle,
*Galaktose
**gesättigte Verbindungen,
**Glycerin
**Grignard
**Grignard-Verbindungen
**Halbacetale,
**Halogenkohlenwasserstoffe,
**Haworth,
**Heptan
**Heterocyclen
**heterocyclische Verbindungen
**Hexachlorbenzol
***Hexadecan
***Hexamethylen
*Hexamethylendiamin
***Hexamethylentetramin
**Hexan
***Hexogen,
**Hofmann,
***homologe Reihen,
**Homolyse
*Hydrazin
**Hydroaromaten
**hydroaromatische Verbindungen,
**Hydroxycarbonsäuren
***Indigo
**Indol
*Indoxyl
***Inversion,
***Isoalkane,
***Isoamylnitrit
**Isobutan,
**Isobutanol
**Isobutylalkohol
**Isobutylen
*Isocyanate,
**Isomere,
**Isopren
**Isopropanol
**Isopropylalkohol
**Jod-Stärke-Reaktion,
*Kakaobutter,
*Kaliumhydrogentartrat
***Ketogruppe,
***Ketone,
*Ketosäuren,
**Ketosen
*Kleesäure
***Kohlenhyrate,
**Kohlenstoffchemie,
**Kohlenwasserstoffe, KW
*Kollodium
**Kolloide
*kondensiertes System
***Konfiguration
***Konstitution
*Krapplacke,
*Kristallviolett,
***Lactame,
**Lactate
*Lactose
**Laurinsäure
**Lee
*Leinöl,
***Liebig,
**Linolsäure
***Lipide
**Lipoide,
***lipophil
**Makromoleküle
**Maleinsäure
**Mandelsäure,
**Mannit
**Mesomerie,
**Metaldehyd,
**metallorganische Verbindungen
**Metallseifen,
**meta-Stellung,
**Methacrylsäure,
*Methan
**Methanol
***Methanolsynthese,
**Methylalkohol
***Methylengruppe,
**Methylviolett,
**Monocarbonsäuren,
**Monomere
***Monosaccharide,
***Muscon,
**Myristinsäure,
**Naphthalin,
**Naphthene
**Naphthole,
**Naturstoffe,
*Nelkenöl,
**Ninhydrin
***Nitrierung,
**Nitrile,
**Nitrilgruppe,
**Nitrobenzol
***Nitrogruppe,
*Nitromethan,
**Nitrosogruppe,
**Nitrosoverbindungen,
**Nitroverbindungen,
**Octane,
*Öle,
***Olefine
*Ölsäure
*organische Chemie,
*organische Verbindungen,
**Oxalsäure
**Oxosynthese
**PAK,
*Palmitate,
*Palmitin,
**Palmitinsäure
*Paraffin
***Paraffine
*Pauling
**PCP,
**Pentan,
**Pentosen,
**Perchlorethylen
***Peroxidzahl,
*Petroleum
***Phenanthren,
**Phenol
**Phenole,
**Phenolphthalein,
***Phosgen
***Phthalsäure
***Phthalsäureanhydrid, PSA
***Pikrinsäure
**Pinen,
**polychlorierte Biphenyle
**polycyclische aromatische Kohlenwasserstoffe
**Propan,
*Propancarbonsäure,
**Propanol
**Propen,
**Propensäure
*Propionsäure,
*Propylalkohol
**Propylen
**Pyridin,
***quartäre Verbindungen
***Racemat
**Radikale,
***Resorcin
*Runge,
**Saccharide
***Saccharin
*Saccharose
**Salicylsäure
**Sandwichverbindungen
**Säureanhydride,
**Säurehalogenide,
**Seignettesalz
*Sorbinsäure
*Sorbit
**Stärke
*Stearin,
**Stearinsäure
**Stellungsisomerie,
***Stereochemie,
***Stereoisomerie
**sterische Hinderung,
*Strychnin
*Styrol
*Substitutionsisomerie
**Sulfogruppe
**Sulfonate
**Sulfonierung
**Sulfonsäuren
**Tautomerie
**Terpentinöl,
**Tetrachlorkohlenstoff
**Tetrahydrofuran, THF
***Thioharnstoff
**Threonin,
***Thymidin,
**Thymolblau,
**Toluol
*Trichlorethylen
**Trinitrotoluol
**Ultramarin
**Umlagerung,
**ungesättigte Verbindung,
***Urethane,
**Valeriansäure,
**Veresterung,
**Vinylchlorid
**Vinylgruppe,
***Weinsäure
*Weinstein
**Willstätter,
**Woodward
**Wurtz
***Xanthen
***Xanthin,
**Xylol
*Ziegler,
**Zucker,
**Zuckersäure
**Zwitterionen,
Anhang
B
C
D
E
F
G
H
I
J
K
M
N
O
P
Q
R
S
T
U
V
W
X
Z
Impressum neobooks
Vorwort
Michael Wächter
Fachbegriffe der Chemie
Definitionen, Grundwissen und Erklärungen zum Nachschlagen und Lernen in Schulen und Homeschooling
Fachbegriffe der Chemie
Definitionen, Grundwissen und Erklärungen zum Nachschlagen und Lernen in Schulen und Homeschooling
Allgemeine, anorganische und organische Chemie
Michael Wächter
Impressum
Texte: © Copyright by Michael WächterUmschlag: © Copyright by Michael Wächter
Verlag: Michael Wächter
Borsigweg 21a 48153 Münster [email protected]
Druck: epubli - ein Service der neopubli
GmbH,Berlin
Von A wie „Abbaureaktion“ bis Z wie „Zyankali“: Wichtige Fachbegriffe aus den Naturwissenschaften kann man ebenso lernen wie Vokabeln in den Fremdsprachen. Auf diesem „Kleinen Einmaleins“ baut sich das gesamte Lehrgebäude der (Schul)-Chemie auf. Wer sie lernt und anwenden kann, der wird im Chemieunterricht klarkommen.
Dieses Buch beginnt daher mit dem Grundwissen der Chemie, den Grundbegriffen. Danach folgen die Fachbegriffe zu den einzelnen Teilgebieten, der allgemeinen, anorganischen und organischen Chemie, alfabetisch geordnet zum Nachschlagen.Nachschlagen, verstehen, lernen: – dieses Buch enthält, was man dazu an Grundwissen für den Chemieunterricht braucht: Fachbegriffe und Definitionen, Erklärungen,Beuispiele, Merksätze und auch einige Formeln.
Zum besseren Verständnis der einzelnen Fachbegriffe empfiehlt es sich manchmal auch, die Sachverhalte in Übungsaufgaben auszuprobieren. Diese sind z.B. in der Reihe „Üb(erleg)ungsaufgaben Chemie“ erschienen – zum Lernen im Homeschooling, durch ausprobieren, learning by doing, try and error.
Viel Erfolg beim Lernen und Anwenden, bei Tests, Klausuren und Abiturprüfungen wünscht der Autor!
Teil 1: Basiswissen Chemie
Teil 1 bietet zunächst die grundlegenden Definitionen, das Grundwissen (Grundbegriffe und erklärende Beispiele hierzu in Form von Merksätzen).
Teil 2 und 3 enthalten dann den Überblick über Fachbegriffe zur Allgemeinenund Anorganischen sowie zur Organischen Chemie in alphabetischer Ordnung.
Grundwissen: Stoffe, Stoffgemische, Stoffumwandlungen
Chemie ist die Lehre von Stoffen und Stoffumwandlungen.
Stoffe (Materialien) sind das, woraus sich wägbare Körper zusammensetzen. Beispiele: Ein Tropfen besteht aus Wasser, ein Materieklumpen aus Gestein, eine Wolke aus Luft und kleinsten Wassertröpfchen, eine 10-Cent-Münze aus Messing.
Stoffumwandlungen (chemische Reaktionen) sind Vorgänge, bei denen mindestens ein neuer Stoff entsteht.Beispiele: Beim Verbrennen von Kohle entsteht das Abgas Kohlendioxid, beim Rosten entsteht aus Eisen, Luft und Wasser Rostpulver.
Stoffe können vermengt vorliegen (als Stoffgemische aus mehreren Einzelbestandteilen) oder in Reinform (Reinstoffe). Beispiel: Salzwasser ist ein Stoffgemisch aus Salz und Wasser.
Reinstoffe haben immer gleichbleibende Stoffeigenschaften, an denen sie erkennbar sind. Beispiel: Reines Wasser ist immer farb- und geschmacklos, gefriert unter „Normalluftdruck“ immer bei 0°C und siedet unter Normalluftdruck immer bei +100°C.
Bei Stoffgemischen hängen die Stoffeigenschaften oft von den einzelnen Reinstoffen (Bestandteilen) und von deren Mischungsverhältnis im Gemisch ab.Beispiel: Wasser schmeckt mit zunehmendem Salzgehalt immer salziger, seine Siedetemperatur steigt mit zunehmendem Salzgehalt und seine Gefriertemperatur (Erstarrungspunkt) sinkt mit zunehmendem Salzgehalt ab.
Das Mischungsverhältnis der einzelnen Reinstoffe (Bestandteile) eines Stoffgemisches ist oft beliebig (manchmal allerdings nur beliebig innerhalb bestimmter Grenzen). Beispiel: In Wasser kann man beliebige Mengen Kochsalz auflösen, sofern man die Löslichkeitsgrenze nicht überschreitet (Sättigungskonzentration, maximal mögliche Konzentration).
Bei chemischen Reaktionen (Stoffumwandlungen) können Reinstoffe zu einem neuen Stoff vereinigt werden (Stoffvereinigung, Synthese), Reinstoffe in neue Reinstoffe zerlegt werden (Stoffzerlegung, Analyse) oder Stoffe umgruppiert werden: Beispiele: (Der Pfeil → bedeutet: „reagiert zu“)
Stoff A + Stoff B → Stoff AB (Stoffvereinigung) Stoff AB → Stoff A + Stoff B (Stoffzerlegung) Stoff AB + Stoff C → Stoff AC + Stoff B Stoff AB + Stoff CD → Stoff AC + Stoff BD (zwei Stoffumgruppierungen)
GrundbegriffeElement und Verbindung
Abbildungen: Gold (oben) und Schwefel (unten) sind zwei chemische Elemente(Abb. Gemeinfrei, wikimedia commons)
Chemisch nicht weiter zerlegbare Reinstoffe werden Elemente genannt. Sie können sich bei chemischen Reaktionen nur mit anderen Reinstoffen zu neuen Stoffen vereinigen (chemische Verbindungen bilden).
Chemisch zerlegbare Reinstoffe werden chemische Verbindungen genannt.
Grundgesetze der Chemie
Wenn also 5 g Kupfer (Symbol: Cu) und 1 g Schwefel zur Reaktion gebracht werden, dann bleibt 1 g Kupfer Cu übrig. Bei der Reaktion von 4 g Kupfer und 4 g Schwefel entstehen 5 g Kupfer(I)-sulfid und 3 g Schwefel bleiben übrig (Symbol: S; oder die 3 g S bzw. Schwefel verbrennen an Luft zu Schwefeldioxid-Gas); weitere Beispiele hierzu:
5 g Kupfer + 1 g Schwefel → 5 g Kupfer(I)-sulfid + 1 g Kupfer4 g Kupfer + 4 g Schwefel (S) → 5 g Kupfer(I)-sulfid + 3 g S 8 g Kupfer + 1 g S → 5 g Kupfer(I)-sulfid + 4 g Kupfer 1 kg Kupfer + 1 kg S → 1,25 kg Kupfer(I)-sulfid +750 kg S10 mg Kupfer + 12,5 mg S → 12,5 mg Kupfer(I)-sulfid + 10 mg S.
Grundwissen zu Teilchen und Arten chemischer Verbindungen
Chemisch unzerlegbare Reinstoffe (Elemente) werden mit Elementsymbolen abgekürzt. Beispiele: Die international festgelegten Symbole der zwölf wichtigsten chemischen Elemente (je 6 Metalle und Nichtmetalle) sind:
Wasserstoff H Kohlenstoff CSauerstoff O Stickstoff NChlor Cl Schwefel SEisen Fe Aluminium AlKupfer Cu Magnesium MgSilber Ag Natrium Na
Metall + Nichtmetall → Salz Metall + Metall → Legierung Nichtmetall + Nichtmetall → molekulare Verbindung.
Beispiele: Kochsalz (Natriumchlorid NaCl) ist eine chemische Verbindung aus dem Leichtmetall Natrium Na und dem grünen Giftgas Chlor: Natrium Na + Chlor Cl → Natriumchlorid NaCl.
Das gelbglänzende Messing ist eine Verbindung (Legierung) aus dem rotglänzenden Kupfer und aus Zink. Wasser ist chemisch zerlegbar in brennbares Wasserstoffgas und brandförderndes Sauerstoffgas. Das Gemisch aus beiden Gasen ist explosiv (Knallgas) und reagiert zu Wasserdampf – am heftigsten im Verhältnis 2 : 1; Reaktionsschema hier: Wasserstoff H + Sauerstoff O → Wasser H2O
Namen und Formeln chemischer Verbindungen
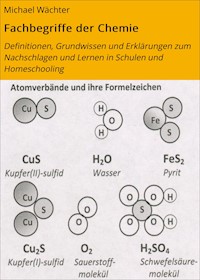
Namen von Salzen aus zwei Elementen bestehen aus dem Metall-Name, ggf. mit Ionenladung, dem Nichtmetall-Namen (oft in lateinischer Form) und der Endung –id Beispiele: Magnesiumoxid MgO, Natriumchlorid NaCl, Natriumoxid Na2O, Kupfer(I)-sulfid Cu2S, Kupfer(II)-sulfid CuS,Eisen(III)-oxid Fe2O3
Achtung: Wenn Sauerstoff als drittes Element hinzukommt und sich mit dem Nichtmetall verbindet, dann endet der Name auf –at. Beispiele:Natriumsulfat Na2SO4, Kalziumcarbonat CaCO3
Beispiele:(Mono-)Kohlen(stoff)monoxid CO (giftig!), (Mono-)Kohlen(stoff)dioxid CO2, Distickstofftrioxid N2O3, Distickstoffmonoxid N2O (Lachgas), Kohlenstofftetrachlorid CCl4, Schwefelhexafluorid SF6‘
Abbildungen:Über die Atomzahlenverhältnisse in den Atomverbänden und die Formeln sind Vergleiche der Masse der Atome möglich. So kommt man auf die Größen „Masse“ und „Stoffmenge“ (vgl. Grundgesetze der Chemie, Kapitel 3, undv Grundwissen zur Physikalischen Chemie, Kap. 13; Bildquelle: eig. Werk).
Reaktionsgleichungen geben die (Formeln der) Ausgangsstoffe und (der) Endstoffe wieder.Große Zahlen geben Stoffmengenverhältnisse an, also dass man mehrere Teilchen bestimmter Stoffe (Formeln) braucht.
Beispiel:Bei der Knallgasreaktion (Merksatz Nr. ) verbinden sich Wasserstoff H2und Sauerstoff O2 im Volumen- und Stoffmengenverhältnis 2 : 1zu Wasserdampf H2O: Wasserstoff + Sauerstoff Wasser(stoffoxid) Aus zwei Litern Wasserstoffgas und 1 Liter Sauerstoffgas werden nach der Explosion und Abkühlung (ohne Kondensation zu flüssigem Wasser) ziemlich genau zwei Liter Wasserdampf.Die Reaktionsgleichung in Formeln ist: 2 H2 + O2 2 H2O (und nicht: 2 H2 + O2 H2O).
Diese Gleichung2 H2 + O2 2 H2O sagt aus: 2 Mol H2 + 1 Mol O2 2 Mol H2O 2 Liter H2-Gas + 1 Liter O2-Gas 2 Liter H2O-Dampf (Gas)2 Moleküle H2 + 1 Molekül O2 2 Moleküle H2O
In ähnlichem Stoffmengenverhältnis reagieren z.B. auch Kupfer Cu und Schwefel S zu Kupfer(I)-sulfid CuS: 2 Mol Cu + 1 Mol S 1 Mol Cu2S. Hier entsteht jedoch nur 1 Mol Produkt – und nicht zwei Moleküle wie bei der Knallgasreaktion. Daraus folgerte der Chemiker Avogadro, dass elementare Gase zweiatomig vorkommen (molekular) – so entdeckte er die „Moleküle“ (vgl. folgende Seite: Gleiche Volumina an Gasen enthalten gleiche Stoffmengen bzw. Anzahlen an Molekülen!).
Erinnerung: Dieses folgt u.a. aus den vorherigen Grundsätzen:Wenn sich Stoffe umwandeln, so reagieren sie chemisch. Chemische Reaktionen sind Vorgänge, bei denen mindestens ein neuer Stoff entsteht (erkennbar an neu auftretenden Stoffeigenschaften).Reaktionsgleichungen geben die (Formeln der) Ausgangsstoffe und (der) Endstoffe wieder.
Elemente bestehen aus Atomen (kleinstmögliche Stoffportionen der Elemente). Bei Reaktionen bilden sie Verbindungen (Teilchen-Umgruppierung), d.h. die Atome der Elemente bilden Atomverbände aus Ionen oder Molekülen (Verbände aus Atomen gleicher Elektronegativität bilden neutrale Verbände.
Grundwissen zu Atomen und Bindungen
Atome weisen im Kern neutrale Teilchen auf (Neutronen, Symbol: n) sowie positiv geladene Teilchen, die Protonen (Symbol: p+). In der Atomhülle befinden sich negativ geladene Elektronen (Symbol: e-, im Vergleich zum Atomkern fast masselos; Rutherford‘sches Atommodell).
Die Elektronen befinden sich in der Atomhülle auf verschiedenen Bahnen (Umlaufbahnen, von innen nach außen mit K, L, M, N, … bezeichnet; Bohr’sches Atommodell, inzwischen „überholt“).
Metalle sind Elemente. Sie sind allesamt Stoffe a) mit hoher elektrischer Leitfähigkeit, b) verformbar, c) glänzend und d) sehr gute Wärmeleiter, weil ihre Atome wenig Außenelektronenhaben (und diese sind recht „locker“ an den Kern gebunden und daher frei beweglich).
Neutrale Atome haben immer gleiche Protonen- und Elektronenzahlen (Ihre Neutronenzahl berechnet sich aus der Differenz der relativen Atommasse zur Ordnungs- bzw. Protonenzahl). Ionen sind elektrisch geladene Atome: Die Anzahl ihrer Elektronen entspricht nicht der Anzahl der Protonen im Kern.
Ionen sind elektrisch geladene Atome oder Atomverbände (Kationen positiv, Elektronenzahl ist kleiner als die Anzahl der Protonen im Atomkern; Anionen negativ, Elektronenzahl ist größer als die Anzahl der Protonen). Beispiele für Ionen: Mg2+, Cl-, S2-, Al3+, SO42-, CH3COO-
Im Periodensystem der Elemente (PSE) sind die Atome in der Reihenfolge ihrer Protonenzahl (im Kern) angeordnet. Nach jedem Edelgasatom (volle Außenschale) beginnt eine neue Zeile (Periode), da das Atom eine Schale hinzubekommt (Bohr’sches Atommodell). Atome von Elementen, die in einer Spalte (Hauptgruppe) untereinander stehen, weisen daher die gleiche Anzahl von Außenelektronen auf.
Abbildung: Ionenkristalle weisen stoffspezifische Formen auf: Natriumchlorid kristallisiert immer würferlförmig, Kalziumfuorid (Flussspat) in oktaedern und wieder andere Mineralien in Doppelspat- oder Oktaeder-Form (eig. Foto)
Abbildung: Metall-Nichtmetall-Verbindungen sind stets salzartig (ionisch): kristallkin und nicht verformbar (spröde, brüchig), von hoher Schmelztemperatur und elektrisch leitfähig nur in Lösung und Schmelze. Iim Foto: Sulfide der Elemente Eisen, Zink, Molybdän und Quecksilber (FeS2, ZnS, MoS2, rechts HgS), mittig auch Quecksilberoxid (HgO) und Quecksilberchlorid (HgCl2).
Die Moleküle von Chlorwasserstoffgas und Wasser sind polar (Chlor- und Sauerstoffatom ziehen das bindende Elektronenpaar stärker an als die Wasserstoffatome): Wasser H2O: H – O – H
Bildquellen: HCl-Bildung: Von Sundance Raphael 16:18, 16. Nov. 2006 (CET) - "own work", https://de.wikibooks.org/w/index.php?curid=34621, Sauerstoffmolekül: https://de.wikibooks.org/wiki/Datei:Sauerstoff_Elektronenschreibweise.svg, Chlormolekül: https://de.wikibooks.org/wiki/Anorganische_Chemie_f%C3%BCr_Sch%C3%BCler/_Die_Atombindung#/media/File:Chlor_Elektronenschreibweise.svg, CH4-Molekül unten rechts: https://de.wikibooks.org/wiki/Datei:Methan_Elektronenschreibweise.svg)
Die Elektronegativität (EN) ist dieKraft, mit der ein Atom in einer Bindung das bindende Elektronenpaar anzieht.
Die EN ist im PSE bei Fluor- und Sauerstoffatomen am höchsten. Mit zunehmendem Abstand des Elementes im PSE vom Fluor sinkt die EN ab.
Elektropositivsind Atome mit geringer Elektronegativität (hohe EN-Differenz: ionische Bindung, Differenz an EN ≈0: unpolar). Besonders elektropositiv sind die Atome unedler Metalle (rechts im PSE stehend).
Es gibt drei wichtige Arten der chemischen Bindung: Ionenbindung (hohe EN-Differenz der Bindungspartner), Atombindung (geringe EN-Differenz) und die metallische Bindung (in Legierungen). Beispiele: Chlorgas, Natriumchlorid und Natrium-Kalium-Legierungen:
(Bildquelle: Eigenes Werk, ebenso die folgende Abbildung)
Atommodelle versuchen, den Aufbau der Atome zu beschreiben – die chemische Bindung zwischen ihnen wird in Bindungsmodellen beschrieben.
Hinweise:
Fachbegriffe aus den Atommodellen neben Atom, Ion und Molekülsind Elementarteilchen und Isotop:
Elementarteilchen sind Bestandteile eines Atoms (Proton p+ und Neutron n im Atomkern, Elektronen e- in der Atomhülle).
Isotope sind Atome eines Elementes (also mit gleicher Protonenzahl) aber von unterschiedlicher Neutronenzahl (also ungleicher Neutronenzahl).
Die Atomhülle ist der fast masselose Bereich des Atoms um den Atomkern. Hier halten sich die Elektronen auf (in Schalen / Orbitalen).
Fachbegriffe aus den Bindungsmodellen neben Elektronegativität und chemischer Bindung sind Orbitaleund Hybridisierung.
Orbitalmodell und MO-Theorie
Die Orbitaltheorie beschreibt den Aufenthaltsbereich der Elektronen in der Atomhülle anders als das Bohr’sches Atommodell nicht auf „Bahnen“ und in „Schalen“, sondern „wellenmechanisch“ in Räumen erhöhter Aufenthaltswahrscheinlichkeit. Elektronen sind hier nicht nur „Teilchen“ sondern auch „stehende Wellen“, die sich in diesen Orbitalen aufhalten.
Vereinfachtes Orbitalmodell: Die Elektronen halten sich im Atom nicht auf Bahnen, sondern in Kugelwolken auf – jeweils zwei in einer Kugelwolke („Elektronenpaare“) und je „Schale“ gibt es vier Kugelwolken („Elektronenoktett“).
Kugelwolkenmodell: Das Elektron befindet sich nicht auf einer festen Bahn, sondern hält sich im Atom mit einer bestimmten Wahrscheinlichkeit in einem zumeist kugelförmigen Raum auf (dem Orbital, der Kugelwolke). Ein zweites Elektron kann hinzukommen, dann aber ist der Aufenthaltsraum voll, ein neuer Aufenthaltsraum wird aufgefüllt. Immer wenn vier Aufenthaltsräume voll sind, geht das nachfolgend aufgefüllte Elektron in einen neuen, leeren Aufenthaltsraum, der eine Schale weiter vom Kern entfernt liegt.
Ein Atomorbital (AO) ist der Aufenthaltsbereich eines Elektrons oder Elektronenpaares in einem Einzelatom(s-,p-,d-,f-Orbital: kugel-, hantel-, doppelhantelförmig usw.). Beispiel: In der innersten und zweitinnersten „Schale“ (1. Energieniveau) existieren kugelförmige s-Atomorbitale (1s, 2s) und in der zweitinnersten Schale (2. Energieniveau) existieren entlang der x-, y- und z-Achse je ein hantelförmiges p-Orbital (2px, 2py, 2pz): Bildquelle: Gemeinfrei, unter https://de.wikipedia.org/wiki/Datei:AOs-3D-dots.pngAbbildung: Computergenerierte Darstellung der Wahrscheinlichkeitsdichte des 1s-Orbitals mithilfe einer (sehr feinen) Punktwolke Bildquelle: R.J.Hall, wikimedia commons, über: https://de.wikipedia.org/wiki/Datei:Orbital_s1.png (GNU-Lizenz für freie Dokumentation)
Ein Hybridorbital (HO) ist der Aufenthaltsbereich eines Elektrons oder Elektronenpaares, der sich aus unterschiedlichen Atomorbitalen gebildet hat (Hybridisierung, Bildung von Mischorbitalen: sp,sp2,sp3,...).Beispiel:Drei 2p-POrbitale und ein 2s-Orbital bilden vier gleichwertige sp3-Mischorbitale (links), während zwei 2p-Orbitale und ein 2s-Orbital ein sp2-Hybridorbital ergeben (rechts): sp3spBildquelle: User:sven, wikimedia commons, über: https://de.wikipedia.org/wiki/Hybridorbital#/media/File:Sp3-Orbital.svg (Lizenz: the Creative CommonsAttribution-Share Alike 3.0 Unported)
Ein Molekülorbital (MO) ist der Aufenthaltsbereich eines Elektrons oder Elektronenpaares in einem Molekül (zwischen Einzelatomen; -Bindung achsensymmetrisch, -Bindung unsymmetrisch durch Beteiligung von p-Orbitalen). MOs bilden sich aus Atom- und Hybridorbitalen (Die MO-Theorie ersetzt die frühere Valenzstruktur-, valence-bond- oder VB-Theorie, die bildende Elektronenpaare beschreibt). Beispiel 1:Zwei Wasserstoffatome bilden ein bindendes Molekülorbital (links) und ein leeres, antibindendes MO (rechts). Bildquelle: Von Benjah-bmm27 - Eigenes Werk, Gemeinfrei, https://commons.wikimedia.org/w/index.php?curid=1970739)
Beispiel 2: Ein Fluorwasserstoff-Molekülorbital entsteht im Fluorwasserstoff-Molekül H-F, wenn ein 1s-Atomorbital vom Wasserstoffatom H (oben links) und ein 2p-Atomorbitakl vom Fluoratom F (oben rechts, hantelförmig) zu einem MO verschmelzen (unten): Bildquelle: Von Leyo - Eigenes Werk, based on Datei:MOHF.jpg by Benutzer:Hati, Gemeinfrei, über: https://commons.wikimedia.org/w/index.php?curid=8948600
Hinweis: Neben den drei Arten chemischer Bindung – der Atom-, Ionen- und Metallbindung – existieren auch Wasserstoffbrückenbindungen und koordinative Bindungen:Eine Wasserstoffbrückenbindung ist eine über Wasserstoffatome locker erfolgte Bindung zwischen zwei polaren Molekülen (Dipol-Dipol-Wechselwirkung) Eine koordinative Bindung ist eine Bindung höherer Ordnung (unabhängig von Wertigkeit und Oxidationszahl) in einem Komplex zwischen einem Nebengruppenmetall-Kation und Molekülen mit freien Elektronenpaaren (Liganden). Ein Ligand ist ein Molekül mit freien Elektronenpaaren in einem Komplex, die Koordinationszahl gibt an, mit wieviel „einzähnigen“ Liganden sich ein Zentralatom in einem Komplex umgeben kann.
Alkali- und Erdalkalimetalle
Verbindungen sind chemisch zerlegbare Reinstoffe, keine Stoffgemische.
Hinweis: Zu den Stoffgemischen gehören z.B. Emulsinen, Suspensionen und Aerosole: Eine Emulsion ist ein Stoffgemenge aus zwei nicht mischbaren Flüssigkeiten (z.B. Öl in Wasser). Eine Suspension ist ein Stoffgemenge / eine Aufschlämmung von unlöslichem Feststoff in einer Flüssigkeit. Ein Aerosol ist ein Stoffgemisch von Flüssigkeit in Gas (z.B. Nebel), ein Kolloid ist eine Aufschlämmung von Feststoff in Flüssigkeit, die sich ohne Ausflockung nicht filtrieren lässt.
Das Zerlegen von Verbindungen (Analyse) ist deshalb immer eine chemische Reaktion – im Unterschied zu Aggregatzustandsänderungen und zu den Stofftrennverfahren, bei denen Stoffgemische in Reinstoffe aufgetrennt werden. Abbildung: Eine Magnettrommel trennt magnetisierbare Stoffe von nichtmagnetischem Material – ein Stofftrennverfahren (ganz ohne Stoffumwandlung / chemische Zerlegung!) Bildquelle: Maettchy, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=1031666
Hinweis: Zu den Stofftrennverfahren gehören Filtration, Destillation und Extraktion. Aggregatzustandsänderungen sind Erstarren (Gefrieren), Sieden, Sublimieren und Kondensieren.
Definitionen dazu:Kondensation ist der Übergang vom gasförmigen zum flüssigen Aggregatzustand, Sublimation ist der Übergang vom festen zum gasförmigen Aggregatzustand. Eine Filtration ist ein Stofftrennverfahren zur Abtrennung unlöslicher Feststoffe aus einer Flüssigkeit (Suspension). Eine Destillation ist ein Stofftrennverfahren zur Auftrennung eines Flüssigkeiten-Gemisches durch Erhitzen über den Siedepunkt der flüchtigeren Substanz mit anschließender Kondensation zur Abtrennung derselben („Destillat“; ein Azeotrop ist ein durch Destillation nicht weiter auftrennbares Flüssigkeitsgemisch). Eine Extraktion ist ein Stofftrennverfahren zur Auftrennung eines Feststoffgemisches, bei dem dessen lösliche Bestandteile durch eine Flüssigkeit (Extraktionsmittels) abgetrennt werden („Extrakt“, „Auszug“). Eine Sedimentation ist die Bildung eines Niederschlages („Ausfällung“) aus einer Suspension, indem der unlösliche Feststoff (das „Sediment“) schwerkraftbedingt absinkt, sich unten absetzt.
Beispiele:4 Li + O2→ 2 Li2O (aus Li+ und O2- 2:1) 2 Mg + O2→ 2 MgO (aus Mg2+ + O2- 1:1) 2 Li + 2 H2O → 2 LiOH + H2 (Li+/OH-) Mg + 2 H2O → 2 Mg(OH)2 (aus Mg2+ / OH- 1:2)
Die Oxide der Alkali- und Erdalkalimetalle bilden in Wasser Laugen (das sind Lösungen der Hydroxide in Wasser, pH > 7; Laugen sind „basisch“, also Lösungen von Basen in Wasser, Wortherkunft von: „die Basis von Salzen“). Beispiele:Li2O + H2O → 2 LiOH Mg + 2 H2O → Mg(OH)2
Laugen (Basen) reagieren mit Säuren zu Salz und Wasser („Neutralisation“).Salze sind also Verbindungen von Metallen mit Nichtmetallenund entstehen aus der Reaktion von Laugen mit Säuren zu Salz und Wasser (Neutralisation): Lauge + Säure → Salz + Wasser Beispiele: NaOH + HCl → NaCl + H2O Natronlauge + Salzsäure → Natriumchlorid + Wasser Mg(OH)2 + 2 HCl → MgCl2 + 2 H2O Magnesiumhydroxid + Salzsäure → Magnesiumchlorid + Wasser
Erdalkalimetalle reagieren nicht ganz so heftig wie Alkalimetalle. Alkalimetall-Salze sind wasserlöslich. Bei den Erdalkalisalzensind Hydroxide kaum und Carbonate und Sulfate überhaupt nicht wasserlöslich (Ausnahme: MgSO4). Beispiele: Löslich sind NaCl, KCl, LiOH, KOH, Na2S, Na2SO4, MgSO4usw., unlöslich sind: CaSO4 (Gips), SrSO4, BaSO4, CaCO3 (Kalk), SrCO3, BaCO3, Ca(OH)2 (kaum lösl.)
Alkali- und Erdalkali-Atome (außer Mg) nehmen in Flammen Energie auf (Absorption) und geben sie als Licht(-energie) wieder ab (Emission). Das Licht kommt, wenn nach außen „angehobene“ Außenelektronen in der Atomhülle wieder „zurückspringen“.
Abb.: Feuerwerk mit Flammfärbung durch Emission (eig. Foto)
Halogene und Halogenide
Abbildung: Chlorgas, Brom- und Ioddampf (Eig. Foto)
Beispiele:2 Na + Cl2 2 NaClMg + I2 MgI2Pb + + I2 PbI2
Hinweis: Bei diesen Reaktionen gibt das Na-Atom seine Außen-e- an Chloratom ab, bei der Bildung von Magnesiumiodid das Mg-Atom 2 Außen-e- an I ab und bei der Bildung von Blei(II)-iodid, gelb, gibt das Pb-Atom 2 e- an je ein Iodatom ab. Bei dieser Elektronenabgabe (Oxidation, ox) entstehen aus den Metallatomen immer Kationen (positiv geladene Atomteilchen), die Nichtmetall-Atome werden durchElektronenaufnahme zu Anionen (negativ geladene Teilchen): F-, Cl-, Br-, I- (Halogenid-Anionen).Kationen und Anionen bilden unter Abgabe von Energie die Salzkristalle (Halogenide).
Die Reaktionsfähigkeit der Halogene nimmt im PSE von unten nach oben stark zu. Fluor F2 ist das reaktionsfähigste Element. Beispiel: Es entflammt Kunststoffe, setzt auch viele Metalle in Brand und reagiert mit Waserstoffgas auch unterhalb von -200 °C noch explosionsartig. Es zersetzt sogar Wasser: 2 F2 + H2O → 2 HF + OF2(Produkt: Sauerstoffdifluorid, brandfördernd).
Säure-Base-Reaktionen (Protolyse, Protonenaustausch)
Überblick: Reaktionen von Säuren und Basen
Reaktionsweisen von Säuren:
1) Nichtmetalloxid + Wasser → Säure (Säure-Bildung)
2) Säure + Metall → Salz + Wasserstoff (Elektronenaustausch)
3) Säure + Metalloxid → Salz + Wasser (Protonenaustausch)
5) Säure + Salz schwächerer Säure → Schwächere Säure + Salz stärkerer Säure
Reaktionsweisen von Basen:
1) Metalloxid + Wasser → Metallhydroxid (= Base; nur bei unedlen Metallen)
2) Base + Säure → Salz + Wasser (Neutralisation, Säure-/Base-Reaktion)
3) Starke Base + Salz der schwächeren Base → Schwächere Base + Salz stärkerer Base
Typ 1-3 sind Protonenübertragungen, Typ 3 zudem eine Verdrängungsreaktion.





























