Erhalten Sie Zugang zu diesem und mehr als 300000 Büchern ab EUR 5,99 monatlich.
- Herausgeber: neobooks
- Kategorie: Wissenschaft und neue Technologien
- Sprache: Deutsch
Was ist eine Neutralisation? Was sind Molekülorbitale und Hybridisierung, pH- und pKS-Werte? Wie definiert man Atom, Absorption und Redoxreaktion? Dieses Merkbuch bietet die Erklärungen der wichtigsten Fachbegriffe, die man im Chemieunterricht braucht, in Form eingängiger Merksätze – für Abitur, Klassenarbeiten, Klausuren, Prüfungen. Die Begriffe werden verständlich und trotzdem kurz erklärt, alphabetisch und nach Fachgebieten und typischen Unterrichtsthemen angeordnet – eingängige Merksätze und Formeln zum Nachschlagen und Lernen, Verstehen und Anwenden; als Lernhilfen ausgewählt und einfach erklärt durch einen Chemielehrer mit langjähriger Erfahrung.
Sie lesen das E-Book in den Legimi-Apps auf:
Seitenzahl: 126
Veröffentlichungsjahr: 2019
Das E-Book (TTS) können Sie hören im Abo „Legimi Premium” in Legimi-Apps auf:
Ähnliche
Michael Wächter
Merksätze und Formeln Chemie
Kleines Lern- und Nachschlagebuch zum Lernen für die Schule und im Homeschooling
Dieses ebook wurde erstellt bei
Inhaltsverzeichnis
Titel
Vorwort
Inhaltsverzeichnis
1) Stoffe, Stoffgemische, Stoffumwandlungen
2) Elemente und Verbindungen
3) Grundgesetze der Chemie
4) Teilchen und Arten chemischer Verbindungen
5) Namen und Formeln chemischer Verbindungen
6) Atome und Bindungen
7) Orbitalmodell und MO-Theorie
8) Alkali- und Erdalkalimetalle
9) Halogene und Halogenide
10) Säure-Base-Reaktionen (Protolyse, Protonenaustausch)
11) Redoxreaktionen (Elektronenaustausch)
12) Komplexe und koordinative Bindung
13) Merksätze Physikalische Chemie
14) Merksätze Elektrizität und Elektrochemie
15) Merksätze Grundlagen der Organischen Chemie
16) Merksätze Stoffgruppen organischer Verbindungen
17) Merksätze Reaktionsmechanismen organischer Verbindungen
18) Merksätze Analytische Chemie
19) Formeln Allgemeine und Anorganische Chemie
20) Formeln Organische Chemie
21) Wichtige Formeln nach Stoffnamen, von A-Z (Register)
22) Formeln, alfabetisch (Register)
23) Fachbegriffe zum Nachschlagen von A bis Z (und ihrer Merksätze) - Register der „Chemie-Vokabeln“)
24) Anhang
Impressum neobooks
Vorwort
Merksätze und Formeln Chemie
Kleines Lern- und Nachschlagebuch zum Lernen für die Schuleund im Homeschooling
Michael Wächter
Impressum
Texte: © Copyright by Michael WächterUmschlag: © Copyright by Michael WächterVerlag: Michael Wächter
Borsigweg 21a48153 Mü[email protected]
Druck: epubli, ein Service der
neopubli GmbH, Berlin
Printed in Germany
Nachschlagen, verstehen, lernen: – dieses Buch enthält, was man für den Chemieunterricht braucht: Merksätze, wichtige Formeln, Fachbegriffe und Gesetze. Auf diesem „Kleinen Einmaleins“ der Chemie baut sich das Lehrgebäude der (Schul)-Chemie auf. Wer sie nachsieht, lernt und kennt, der wird im Chemieunterricht klarkommen. Wichtige Fachbegriffe kann man schließlich ebenso lernen wie in den Fremdsprachen die Vokabeln. Die Merksätze beginnen mit denen zu den Grundlagen, danach folgen die Merksätze zu den einzelnen Teilgebieten, die darauf aufbauen (siehe Inhaltsverzeichnis).
Zum besseren Verständnis der einzelnen „Gesetze“ und „Lehrsätze“ empfiehlt es sich manchmal auch, ihre Anwendung in Übungsaufgaben auszuprobieren – Lernen durch ausprobieren, learning by doing, try and error.
Viel Erfolg beim Lernen und Anwenden, bei Tests, Klausuren und Abiturprüfungen wünscht der Autor!
Inhaltsverzeichnis
Inhalte (mit Nr. der Merksätze und Seitenzahlen der Printversion dieses Buches)
Teil 1: Merksätze zu Grundbegriffen der Chemie
1) Stoffe, Stoffgemische, Stoffumwandlungen Nr. 1-8 / ab S. 5
2) Elemente und Verbindungen Nr. 9-10 / ab S. 7
3) Grundgesetze der Chemie Nr. 11-14 / ab S. 7
4) Teilchen und Arten chemischer Verbindungen Nr. 15-24 / S.11
5) Namen und Formeln chem. Verbindungen Nr. 25-29 / S.14
6) Atome und Bindungen Nr. 30-48 / S.18
7) Orbitalmodell und MO-Theorie Nr. 49-54 / S.25
8) Alkali- und Erdalkalimetalle Nr. 55-63 / S.30
9) Halogene und Halogenide Nr. 64-72 / S.33
10) Säure-Base-Reaktionen Nr. 73-78 / S.37
11) Redoxreaktionen Nr. 88-101/ S.40
12) Komplexe und koordinative Bindung Nr. 102-109/ S.45
Teil 2: Merksätze zu Einzelgebieten
13) Merksätze Physikalische Chemie Nr.110-143 / ab S. 50
14) Merksätze Elektrizität und Elektrochemie Nr. 144-158 / ab S. 61
15) Merksätze Grundlagen der Organischen Chemie Nr. 159-166 / S.67
16) Merksätze Stoffgruppen organischer Verbindungen Nr. 167-175 / S.76
17) Merksätze Reaktionsmechanismen org. Verb. Nr. 176-200 / S.81
18) Merksätze Analytische Chemie Nr. 201-227 / S.100
Teil 3: Formeln und Fachbegriffe zum Nachschlagen
19) Formeln Allgemeine und Anorganische Chemie ab S.110
20) Formeln Organische Chemie ab S.112
21) Wichtige Formeln nach Stoffnamen von A-Z ab S.115
22) Formeln, alfabetisch (Register) ab S.121
23) Fachbegriffe zum Nachschlagen von A bis Z ab S.128
24) Anhang (weitere Informationen und Lernhilfen) ab S.147
1) Stoffe, Stoffgemische, Stoffumwandlungen
1) Chemie ist die Lehre von Stoffen und Stoffumwandlungen.
2) Stoffe (Materialien) sind das, woraus sich wägbare Körper zusammensetzen. Beispiele: Ein Tropfen besteht aus Wasser, ein Materieklumpen aus Gestein, eine Wolke aus Luft und kleinsten Wassertröpfchen, eine 10-Cent-Münze aus Messing.
3) Stoffumwandlungen (chemische Reaktionen) sind Vorgänge, bei denen mindestens ein neuer Stoff entsteht.Beispiele: Beim Verbrennen von Kohle entsteht das Abgas Kohlendioxid, beim Rosten entsteht aus Eisen, Luft und Wasser Rostpulver.
4) Stoffe können vermengt vorliegen (als Stoffgemische aus mehreren Einzelbestandteilen) oder in Reinform (Reinstoffe). Beispiel: Das Stoffgemisch Salzwasser besteht aus Salz und Wasser.
5) Reinstoffe haben immer gleichbleibende Stoffeigenschaften, an denen sie erkennbar sind. Beispiel: Reines Wasser ist immer farb- und geschmacklos, gefriert unter „Normalluftdruck“ immer bei 0°C und siedet unter Normalluftdruck immer bei +100°C.
6) Bei Stoffgemischen hängen die Stoffeigenschaften oft von den einzelnen Reinstoffen (Bestandteilen) und von deren Mischungsverhältnis im Gemisch ab. Beispiel: Wasser schmeckt mit zunehmendem Salzgehalt immer salziger, seine Siedetemperatur steigt mit zunehmendem Salzgehalt und seine Gefriertemperatur (Erstarrungspunkt) sinkt mit zunehmendem Salzgehalt ab.
7) Das Mischungsverhältnis der einzelnen Reinstoffe (Bestandteile) eines Stoffgemisches ist oft beliebig (manchmal allerdings nur beliebig innerhalb bestimmter Grenzen). Beispiel: In Wasser kann man beliebige Mengen Kochsalz auflösen, sofern man die Löslichkeitsgrenze nicht überschreitet (Sättigungskonzentration, maximal mögliche Konzentration).
8) Bei chemischen Reaktionen (Stoffumwandlungen) können Reinstoffe zu einem neuen Stoff vereinigt werden (Stoffvereinigung, Synthese), Reinstoffe in neue Reinstoffe zerlegt werden (Stoffzerlegung, Analyse) oder Stoffe umgruppiert werden: Beispiele: (Der Pfeil → bedeutet: „reagiert zu“)
Stoff A + Stoff B → Stoff AB (Stoffvereinigung) Stoff AB → Stoff A + Stoff B (Stoffzerlegung) Stoff AB + Stoff C → Stoff AC + Stoff B Stoff AB + Stoff CD → Stoff AC + Stoff BD (zwei Stoffumgruppierungen)
2) Elemente und Verbindungen
9) Chemisch nicht weiter zerlegbare Reinstoffe werden Elemente genannt. Sie können sich bei chemischen Reaktionen nur mit anderen Reinstoffen zu neuen Stoffen vereinigen (chemische Verbindungen bilden).
10) Chemisch zerlegbare Reinstoffe werden chemische Verbindungen genannt.
Bild, von links nach rechts: Kupfer, Reagenzglas mit Kupferazetat und Kupfer, Kupfer(II)oxid - schwarz, oben - Kupfer(I)oxid (rot) und Kupfer(II)Sulfid, schwarz, unten, mittig: Schwefelpulver (zitronengelb), rechts Patina (grünlich) und Kupfer(II)sulfathydrat (blau). Kupfer ist ein Element, das Andere sind Kupferverbindungen. Im Reagenzglas wurde das blaugrüne Salz Kupfer(II)Azetat durch Erhitzen in seine Bestandteile zerlegt, wobei Kupfer im Reagenzglas zurückbleibt. - eig. Foto
Stoffe im Chemielabor (eig. Foto)
3) Grundgesetze der Chemie
Beispiel: Wenn sich 4,0 g Kupfer mit 1,0 g Schwefel verbinden, dann entstehen immer genau 5,0 g schwarzes Kupfer(I)-sulfid. Diese Verbindung besteht aus Kupfer und Schwefel, Reaktion: Kupfer + Schwefel → Kupfer(I)-sulfid, eine Stoffvereinigung.
Wenn also 5 g Kupfer (Symbol: Cu) und 1 g Schwefel zur Reaktion gebracht werden, dann bleibt 1 g Kupfer Cu übrig. Bei der Reaktion von 4 g Kupfer und 4 g Schwefel entstehen 5 g Kupfer(I)-sulfid und 3 g Schwefel bleiben übrig (Symbol: S; oder die 3 g S bzw. Schwefel verbrennen an Luft zu Schwefeldioxid-Gas); weitere Beispiele hierzu:
5 g Kupfer + 1 g Schwefel → 5 g Kupfer(I)-sulfid + 1 g Kupfer 4 g Kupfer + 4 g Schwefel (S) → 5 g Kupfer(I)-sulfid + 3 g S 8 g Kupfer + 1 g S → 5 g Kupfer(I)-sulfid + 4 g Kupfer 1 kg Kupfer + 1 kg S → 1,25 kg Kupfer(I)-sulfid +750 kg S 10 mg Kupfer + 12,5 mg S → 12,5 mg Kupfer(I)-sulfid + 10 mg S.
14) Aus dem Gesetz der multiplen Proportionen (dem Verhältnis kleiner, ganzer Zahlen) folgt, dass chemische Verbindungen und Elemente aus kleinsten, unteilbaren Stoffportionen oder Einheiten bestehen – den Atomen (Atomhypothese von Dalton). Beispiel: Es ist mit Verbindungen ähnlich wie Kachelmustern: Auch sie bestehen aus einzelnen Kacheln in ganz bestimmten Mengenverhältnissen. Für jedes Muster ist das Mengenverhältnis unterschiedlich – genau wie bei chemischen Verbindungen (denn Kachelmuster und Verbindungen bestehen beide aus kleinsten Einheiten).
4) Teilchen und Arten chemischer Verbindungen
15) Chemisch unzerlegbare Reinstoffe (Elemente) werden mit Elementsymbolen abgekürzt. Beispiele: Die international festgelegten Symbole der zwölf wichtigsten chemischen Elemente (je 6 Metalle und Nichtmetalle) sind:
Wasserstoff H Kohlenstoff CSauerstoff O Stickstoff NChlor Cl Schwefel SEisen Fe Aluminium AlKupfer Cu Magnesium MgSilber Ag Natrium Na
16) Metalle sind glänzend, verformbar, elektrisch leitend und gute Wärmeleiter. Nichtmetalle leiten den elektrischen Strom nicht (Isolatoren, Nichtleiter).
17) Die kleinstmöglichen Stoffportionen der Elemente sind die Atome. Alle Atome eines Elementes haben annähernd die gleiche Masse. Sie bestehen aus einem Kern und einer Hülle, in der sich negative Ladungen befinden – die Elektronen.
18) Wenn Elemente Verbindungen bilden, dann vereinigen sich die Atome dieser Elemente zu Atomverbänden (z.B. zu Molekülen). Diese Atomverbände sind die kleinstmöglichen Stoffportionen chemischer Verbindungen.
19) Unabhängig von der Masse von chemisch reagierenden Stoffportionen sind bestimmte Mengen von Stoffen einander chemisch gleichwertig. Die Masse m einer Stoffportion (abgewogen in Gramm, g, oder Kilogramm, kg) entspricht deshalb nicht ihrer Stoffmenge n (angegeben in Mol). Vergleichsbeispiel: Auch eine Menge von 10 Menschen hat nicht immer die gleiche Masse, denn 10 Säuglinge wiegen weniger als 10 Sumo-Ringer.
21) a) Verbindungen von Metallen mit Nichtmetallen sind Salze (ionische Verbindungen), b) Verbindungen von Metallen mit Metallen sind Legierungen (metallische Verbindungen) c) Verbindungen von Nichtmetallen mit Nichtmetallen sind molekulare Verbindungen:
Metall + Nichtmetall → Salz Metall + Metall → Legierung Nichtmetall + Nichtmetall → molekulare Verbindung.
Beispiele: Kochsalz (Natriumchlorid NaCl) ist eine chemische Verbindung aus dem Leichtmetall Natrium Na und dem grünen Giftgas Chlor: Natrium Na + Chlor Cl → Natriumchlorid NaCl. Das gelbglänzende Messing ist eine Verbindung (Legierung) aus dem rotglänzenden Kupfer und aus Zink. Wasser ist chemisch zerlegbar in brennbares Wasserstoffgas und brandförderndes Sauerstoffgas. Das Gemisch aus beiden Gasen ist explosiv (Knallgas) und reagiert zu Wasserdampf – am heftigsten im Verhältnis 2 : 1; Reaktionsschema hier: Wasserstoff H + Sauerstoff O → Wasser H2O
22) Wenn Metalle chemisch reagieren (sich mit anderen Stoffen vereinigen / verbinden), dann geben ihre Atome die äußeren Elektronen aus der Atomhülle ab. Die Anzahl der Außenelektronen entspricht der Hauptgruppen-Nummer im Periodensystem (PSE), der Tabelle der chemischen Elemente.
Nichtmetalle stehen im Periodensystem weiter oben und rechts. Ihre Atome nehmen Elektronen auf (vgl. unten Merksatz 24), Metallatome hingegen geben sie ab ("Oxidation"). Hier im Bild sind links Kohlenstoff und Silizium zu sehen, roter Phosphor, gelbes Schwefelpulver und ganz rechts schwarzglänzende Iodkristalle (eig. Foto).
23) Bei dieser Elektronenabgabe (Oxidation, ox) entstehen aus Metallatomen immer Kationen (positiv geladene Atomteilchen), die Ionenladung entspricht der Hauptgruppenzahl im PSE; bei Nebengruppen wird die Ionenladung als römische Ziffer in Klammern angegeben: Beispiele: Li → Li+ + e- Mg → Mg2+ + 2 e- Cu → Cu2+ + 2 e-[Kupfer(II)-Kation]
5) Namen und Formeln chemischer Verbindungen
25) Namen von Salzen aus zwei Elementen bestehen aus dem Metall-Name, ggf. mit Ionenladung, dem Nichtmetall-Namen (oft in lateinischer Form) und der Endung –id
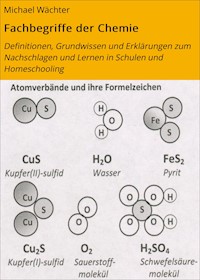
Beispiele: Magnesiumoxid MgO, Natriumchlorid NaCl, Natriumoxid Na2O, Kupfer(I)-sulfid Cu2S, Kupfer(II)-sulfid CuS, Eisen(III)-oxid Fe2O3
Achtung: Wenn Sauerstoff als drittes Element hinzukommt und sich mit dem Nichtmetall verbindet, dann endet der Name auf –at. Beispiele:Natriumsulfat Na2SO4, Kalziumcarbonat CaCO3
Beispiele:(Mono-)Kohlen(stoff)monoxid CO (giftig!), (Mono-)Kohlen(stoff)dioxid CO2, Distickstofftrioxid N2O3, Distickstoffmonoxid N2O (Lachgas), Kohlenstofftetrachlorid CCl4, Schwefelhexafluorid SF6‘
27) Elementare Gase sind zweiatomig (Ausnahme: Edelgase), da sich ihre Atome miteinander verbinden. Beispiele: Sauerstoff O2, Chlor Cl2, Wasserstoff H2, Iod(dampf) I2, Stickstoff N2.
28) Formeln enthalten kleine, tiefgestellte Zahlen für die Anzahl der Atome im Molekül oder die Mengenverhältnisse der Ionen im Salzkristall. Man bildet sie aus den Namen der Verbindungen nach oben genannten Regeln: Elementsymbole für die Element-Namen einsetzen und kleine, tiefgestellte Zahlen für die Stoffmengenverhältnisse der Elemente in dieser Verbindung.
29) Reaktionsgleichungen geben die (Formeln der) Ausgangsstoffe und (der) Endstoffe wieder.Große Zahlen geben Stoffmengenverhältnisse an, also dass man mehrere Teilchen bestimmter Stoffe (Formeln) braucht.
Beispiel:Bei der Knallgasreaktion (Merksatz Nr. ) verbinden sich Wasserstoff H2und Sauerstoff O2 im Volumen- und Stoffmengenverhältnis 2 : 1zu Wasserdampf H2O: Wasserstoff + Sauerstoff → Wasser(stoffoxid) Aus zwei Litern Wasserstoffgas und 1 Liter Sauerstoffgas werden nach der Explosion und Abkühlung (ohne Kondensation zu flüssigem Wasser) ziemlich genau zwei Liter Wasserdampf.Die Reaktionsgleichung in Formeln ist: 2 H2 + O2→ 2 H2O (und nicht: 2 H2 + O2→ H2O).
Diese Gleichung 2 H2 + O2→ 2 H2O sagt aus:
2 Mol H2 + 1 Mol O2 → 2 Mol H2O 2 Liter H2-Gas + 1 Liter O2-Gas → 2 Liter H2O-Dampf (Gas) 2 Moleküle H2 + 1 Molekül O2→ 2 Moleküle H2O
In ähnlichem Stoffmengenverhältnis reagieren z.B. auch Kupfer Cu und Schwefel S zu Kupfer(I)-sulfid CuS: 2 Mol Cu + 1 Mol S→ 1 Mol Cu2S. Hier entsteht jedoch nur 1 Mol Produkt (vgl. Merksatz Nr. 20) – und nicht zwei Moleküle wie bei der Knallgasreaktion. Daraus folgerte der Chemiker Avogadro, dass elementare Gase zweiatomig vorkommen (molekular, vgl. Merksatz 27) – so entdeckte er die „Moleküle“.
Erinnerung: Dieses folgt u.a. aus Merksatz Nr. 17 bis 20:Wenn sich Stoffe umwandeln, so reagieren sie chemisch. Chemische Reaktionen sind Vorgänge, bei denen mindestens ein neuer Stoff entsteht (erkennbar an neu auftretenden Stoffeigenschaften).Reaktionsgleichungen geben die (Formeln der) Ausgangsstoffe und (der) Endstoffe wieder.
Elemente bestehen aus Atomen (kleinstmögliche Stoffportionen der Elemente). Bei Reaktionen bilden sie Verbindungen (Teilchen-Umgruppierung), d.h. die Atome der Elemente bilden Atomverbände aus Ionen oder Molekülen (Verbände aus Atomen gleicher Elektronegativität bilden neutrale Verbände.